Die Entstehung von Salzlagerstätten
Beginnen wir mit einem kleinen Exkurs: Die Gesamtmenge des Wassers auf der Erde beträgt etwa 1,4 Milliarden km³. Jedoch ist nur etwa 2,4 Prozent ist Süßwasser, wovon nur etwa 0,1 Prozent als Trinkwasser zugänglich ist. Salzwasser ist also mit 97,6 Prozent der überwiegende Anteil.
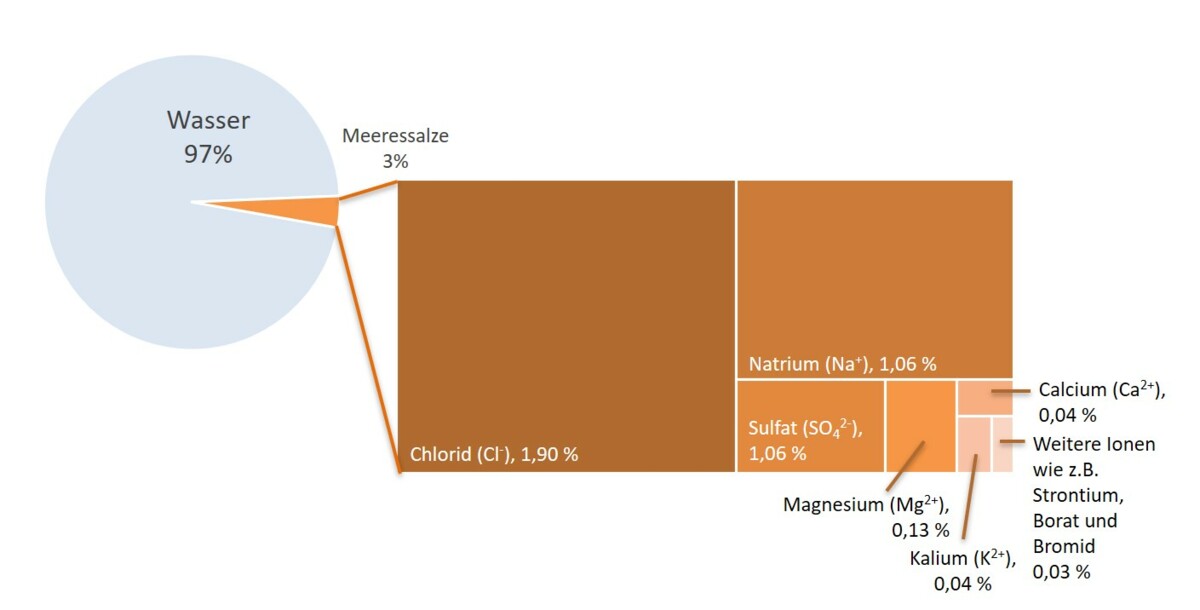
Im Meerwasser sind verschiedene Stoffe in Form von Ionen gelöst. Die wichtigsten in Meerwasser enthaltenen Stoffe sind Natrium-, Kalzium-, Magnesium-, Chlor-, Karbonat- und Sulfationen. Daneben enthält Meerwasser noch zahlreiche Spurenelemente. Diese Ionen lösen sich unterschiedlich gut in Wasser, Kochsalz (also Na+ und Cl- Ionen) ist zum Beispiel sehr gut löslich.
Das Diagramm zeigt die wichtigsten gelösten Ionen.
Bild: eigene Darstellung nach Daten des Lexikons der Geowissenschaften
In den Ozeanen beträgt der durchschnittliche Salzgehalt 3,5 Prozent. Dieser Anteil kann jedoch stark schwanken: in der Ostsee bei nur etwa 1 – 1,5 Prozent, im Mittelmeer 3,8 Prozent, das Rote Meer hat einen Salzgehalt von etwa 4 Prozent und das Tote Meer etwa 28 Prozent [2].
Ursache für die unterschiedlichen Salzgehalte ist unser Wasserkreislauf mit Verdunstung und Niederschlag. In ariden Klimazonen ist die Verdunstungsrate von Meerwasser besonders hoch, die im Wasser gelösten Stoffe bleiben aber zurück und reichern sich somit an. Insbesondere in Nähe der Küste in Flachwasserlagunen und in Binnenmeeren kann durch diesen Prozess der Salzgehalt stark erhöht sein. Andererseits wird er durch Niederschläge, Flusswassereintrag sowie durch Abschmelzen von Eis verringert. Die Ostsee liegt im humiden Klimabereich mit hohen Niederschlägen.
Die Verdunstung des Wassers führt dazu, dass die Konzentrationen der Ionen immer weiter steigen. Ist eine Grenze erreicht, auch Lösungsgleichgewicht genannt, fallen diese Ionen als Salze in Form von Kristallen aus. Ein einfaches Experiment dazu ist die Kochsalzlösung, die so lange erhitzt wird, bis ausreichend Wasser verdampft ist und sich Kristalle zeigen. Jedes Salz hat dabei seine eigene Grenze und fällt damit bei unterschiedlichen Konzentrationen aus. Meerwasser besteht nun aus verschiedenen Ionen. Das heißt also: Würde man eine Wassersäule aus Meerwasser von 1.000 m eindampfen, so würde sich eine typische Abfolge verschiedener sogenannter Evaporite mit einer Mächtigkeit von etwa 16 Metern bilden [3]. Evaporite sind Gesteine, die sich durch Verdunstung von Wasser bilden.
Zu Beginn bildet sich Kalkstein (CaCO3), gefolgt von Gips und Anhydrit. Die Minerale Gips und Anhydrit bilden sich beide aus den Ionen Kalzium Ca2+ und Sulfat SO42-, aber Anhydrit enthält kein molekular gebundenes Wasser. Erst dann fallen die Salze aus, allen voran das Steinsalz (NaCl). Kalisalze haben eine höhere Löslichkeit und bilden sich erst, wenn über 98% des Wassers bereits verdunstet sind. Diese sogenannte Evaporitsequenz ist nur selten vollständig, da durch das immer wieder nachfließende Meerwasser der Eindampfungszyklus gestört wird.
Die im Zechsteinbecken in Norddeutschland abgelagerten Salzlagen erreichten möglicherweise eine Mächtigkeit von 1.400 m im Zentrum [1]. Das bedeutet jedoch nicht, dass der Ozean viele Kilometer tief war, sondern das Becken muss relativ flach gewesen sein, vergleichbar mit der Shark bay in Westaustralien. Da es mit dem offenen Ozean verbunden war, konnte ständig frisches Meerwasser nachfließen und das Verdunstende ersetzen. Deshalb senkte sich das Becken im Laufe der Jahrmillionen unter dem Gewicht der ausfallenden Evaporite langsam ab.
[1] Elsner, H. (18.10.2016). Salze in Deutschland(Juni 2016.). Hannover: BGR (URL: https://www.bgr.bund.de/DE/Themen/Min_rohstoffe/Downloads/studie_salz_2016.pdf?__blob=publicationFile&v=10, letzter Zugriff am 15.07.2018.)
[2] Lensky, N. G. (2005). Water, salt, and energy balances of the Dead Sea : MASS AND ENERGY BALANCES OF THE DEAD SEA: MASS AND ENERGY BALANCES OF THE DEAD SEA. Water Resources Research, 41(12)., doi:10.1029/2005wr004084
[3] Universitaet Tübingen (2017/18): Gesteinskundeskript für die Übungen zu Dynamik der Erde, URL: http://www.uni-tuebingen.de/fileadmin/Uni_Tuebingen/Fakultaeten/MatNat/Fachbereiche/Geowissenschaften/Arbeitsgruppen/Mineralogie___Geodynamik/Petrologie_und_Mineralische_Rohstoffe/Gesteinskundeskript_2017_2018.pdf, letzter Zugriff am 27.06.2018.